| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
lunes, 28 de noviembre de 2011
CUADRO DE CONDUCTIVIDAD ELECTRICA
domingo, 27 de noviembre de 2011
PH
pH
El pH (potencial de hidrógeno) es una medida de la acidez o alcalinidad de una disolución. El pH indica la concentración de iones hidronio [H3O+] presentes en determinadas sustancias. La sigla significa "potencial de hidrógeno" (pondus Hydrogenii o potentia Hydrogenii; del latín pondus, n. = peso; potentia, f. = potencia; hydrogenium, n. = hidrógeno). Este término fue acuñado por el químico danés Sørensen, quien lo definió como el logaritmo negativo en base 10 de la actividad de los iones hidrógeno. Esto es:Por ejemplo, una concentración de [H3O+] = 1 × 10–7 M (0,0000001) es simplemente un pH de 7 ya que: pH = –log[10–7] = 7
El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 (el valor del exponente de la concentración es mayor, porque hay más protones en la disolución) , y alcalinas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolución (cuando el disolvente es agua).
El pH se define como el logaritmo negativo de base 10 de la actividad de los iones hidrógeno:
Puesto que el agua está disociada en una pequeña extensión en iones OH– y H3O+, tenemos que:
- K(constante)w(water; agua) = [H3O+]·[OH–]=10–14 en donde [H3O+] es la concentración de iones hidronio, [OH−] la de iones hidroxilo, y Kw es una constante conocida como producto iónico del agua, que vale 10−14.
- log Kw = log [H3O+] + log [OH–]
- –14 = log [H3O+] + log [OH–]
- 14 = –log [H3O+] – log [OH–]
- pH + pOH = 14
En disoluciones no acuosas, o fuera de condiciones normales de presión y temperatura, un pH de 7 puede no ser el neutro. El pH al cual la disolución es neutra estará relacionado con la constante de disociación del disolvente en el que se trabaje.
Medida del pH
El valor del pH se puede medir de forma precisa mediante un potenciómetro, también conocido como pH-metro, un instrumento que mide la diferencia de potencial entre dos electrodos: un electrodo de referencia (generalmente de plata/cloruro de plata) y un electrodo de vidrio que es sensible al ion de hidrógeno.También se puede medir de forma aproximada el pH de una disolución empleando indicadores, ácidos o bases débiles que presentan diferente color según el pH. Generalmente se emplea papel indicador, que se trata de papel impregnado de una mezcla de indicadores cualitativos para la determinación del pH. El papel de litmus o papel tornasol es el indicador mejor conocido. Otros indicadores usuales son la fenolftaleína y el naranja de metilo.
- A pesar de que muchos potenciómetros tienen escalas con valores que van desde 1 hasta 14, los valores de pH también pueden ser aún menores que 1 o aún mayores que 14. Por ejemplo el ácido de batería de automóviles tiene valores cercanos de pH menores que uno, mientras que el hidróxido de sodio 1 M varía de 13,5 a 14.
- Un pH igual a 7 es neutro, menor que 7 es ácido y mayor que 7 es básico a 25 °C. A distintas temperaturas, el valor de pH neutro puede variar debido a la constante de equilibrio del agua (Kw).
En 1909, el químico danés Sorensen definió el potencial hidrógeno (pH) como el logaritmo negativo de la concentración molar (más exactamente de la actividad molar) de los iones hidrógeno.
OXIDOS, BASES Y ACIDOS
Óxido
Un óxido es un compuesto binario que contiene uno o varios átomos de oxígeno (presentando el oxígeno un estado de oxidación -2) y otros elementos. Existe una gran variedad de óxidos, algunos de los cuales pueden encontrarse en estado gaseoso, otros en estado líquido y otros en estado sólido a temperatura ambiente. Casi todos los elementos forman combinaciones estables con oxígeno y muchos en varios estados de oxidación. Debido a esta gran variedad las propiedades son muy diversas y las características del enlace varían desde el típico sólido iónico hasta los enlaces covalentes. Por ejemplo, son óxidos el óxido nítrico (NO) o el dióxido de nitrógeno (NO2). Los óxidos son muy comunes y variados en la corteza terrestre. Los óxidos no metálicos también son llamados anhídridos porque son compuestos que han perdido una molécula de agua dentro de sus moléculas. Por ejemplo, al hidratar anhídrido carbónico en determinadas condiciones puede obtenerse ácido carbónico:En general, los óxidos se pueden sintetizar directamente mediante procesos de oxidación; por ejemplo, óxidos básicos con elementos metálicos (alcalinos, alcalinotérreos o metales de transición) como el magnesio:
- 2Mg + O2 → 2 MgO;
- P4 + 5O2 → 2 P2O5
Base (química)
- KOH → OH− + K+ (en disolución acuosa)
Ácido
Un ácido (del latín acidus, que significa agrio) es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7. Esto se aproxima a la definición moderna de Johannes Nicolaus Brønsted y Martin Lowry, quienes definieron independientemente un ácido como un compuesto que dona un catión hidrógeno (H+) a otro compuesto (denominado base). Algunos ejemplos comunes incluyen al ácido acético (en el vinagre), y al ácido sulfúrico (usado en baterías de automóvil). Los sistemas ácido/base se diferencian de las reacciones redox en las cuales no hay un cambio en el estado de oxidación. Los ácidos pueden existir en forma de sólidos, líquidos o gases, dependiendo de la temperatura. También pueden existir como sustancias puras o en solución.
A las sustancias químicas que tienen la propiedad de un ácido se les denomina ácidas.
MODELO DE CONDUCTIVIDAD (anodo y catodo)
Ánodo
El ánodo es un electrodo en el cual se produce la reacción de oxidación.Un error muy extendido es que la polaridad del ánodo es siempre positiva (+). Esto es a menudo incorrecto y la polaridad del ánodo depende del tipo de dispositivo, y a veces incluso en el modo que opera, según la dirección de la corriente eléctrica, basado en la definición de corriente eléctrica universal. En consecuencia, en un dispositivo que consume energía el ánodo es positivo, y en un dispositivo que proporciona energía el ánodo es negativo.
El término fue utilizado por primera vez por Faraday (serie VII de las Investigaciones experimentales sobre la electricidad), con el significado de camino ascendente o de entrada, pero referido exclusivamente al electrolito de una celda electroquímica. Su vinculación al polo positivo del correspondiente generador implica la suposición de que la corriente eléctrica marcha por el circuito exterior desde el polo positivo al negativo, es decir, transportada por cargas positivas.
Parecería lógico definir el sentido de la corriente eléctrica como el sentido del movimiento de las cargas libres, sin embargo, si el conductor no es metálico, también hay cargas positivas moviéndose por el conductor externo (el electrolito de nuestra celda) y cualquiera que fuera el sentido convenido existirían cargas moviéndose en sentidos opuestos. Se adopta por tanto, el convenio de definir el sentido de la corriente al recorrido por las cargas positivas cationes, y que es por tanto el del positivo al negativo (ánodo - cátodo).
En el caso de las válvulas termoiónicas, fuentes eléctricas, pilas, etc. el ánodo es el electrodo o terminal de mayor potencial. En una reacción redox corresponde al elemento que se oxidará.
Cátodo
El cátodo es el electrodo de una circuito por el cual la corriente sale de un circuito o aparato eléctrico. En él se produce la reacción de reducción.
Un error muy extendido es pensar que la polaridad del cátodo es siempre negativa (-). La polaridad del cátodo depende del tipo de dispositivo, y a veces incluso en el modo que opera, según la dirección de la corriente eléctrica, basado en la definición de corriente eléctrica universal. En consecuencia, en un dispositivo que consume energía el cátodo es negativo, y en un dispositivo que proporciona energía el cátodo es positivo.
El término fue inventado por Faraday (serie VII de las Investigaciones experimentales sobre la electricidad) [1], con el significado de camino descendente o de salida, pero referido exclusivamente al electrolito de una celda electroquímica. Su vinculación al polo negativo del correspondiente generador implica la suposición de que la corriente eléctrica marcha por el circuito exterior desde el polo positivo al negativo, es decir, transportada por cargas positivas, convención que es la usual. Si el conductor externo fuera metálico, está demostrado que el sentido de la corriente realmente es el recorrido por los electrones hacia el positivo.
Sin embargo, en una célula electrolítica, el conductor es el electrolito, no un metal, y en él pueden coexistir iones negativos y positivos que tomarían sentidos opuestos al desplazarse. Por convenio se adopta que el sentido de la corriente es el del ánodo al cátodo o, lo que es lo mismo, del positivo al negativo.
En el caso de las válvulas termoiónicas, diodos, tiristores, fuentes eléctricas, pilas, etc. el cátodo es el electrodo o terminal de menor potencial y es la fuente primaria de emisión de electrones. Por ende, en una reacción redox corresponde al elemento que se reducirá.


SOLVATACION
Solvatación
La solvatación es el proceso de asociación de moléculas de un disolvente con moléculas o iones de un soluto. Al disolverse los iones en un solvente, se dispersan y son rodeados por moléculas de solvente. A mayor tamaño del ion, más moléculas de solvente son capaces de rodearlo, y más solvatado se encuentra el ion.Diferencia entre solvatación, disolución y solubilidad
Por definición de la IUPAC,[1] la solvatación es una interacción de un soluto con un solvente que conduce a la estabilización de las especies del soluto en la solución. También se puede referir a estado solvatado, donde un ion en una solución está complexado por moléculas del solvente. El concepto de interacción de solvatación también puede ser aplicado a un material insoluble, por ejemplo, la solvatación de los grupos funcionales en la superficie de una resina de intercambio iónico.El fenómeno de solvatación debería ser separado conceptualmente del soluto y de la propiedad de solubilidad. La disolución es un proceso cinético, y se cuantifica por su velocidad. La solubilidad cuantifica el estado de equilibrio dinámico alcanzado cuando la velocidad de disolución iguala a la velocidad de precipitación.
Si se consideran las unidades puede hacerse una distinción más clara. La complexación puede ser descrita por el número de coordinación, y la constante de estabilidad del complejo. La unidad típica para la velocidad de disolución es mol/s. La unidad para la solubilidad puede ser mol/kg.
MODELO DE SOLVATACION
La solvatación separa el compuesto. Proceso que consiste en la atracción y agrupación de las moléculas que conforman un disolvente.
EJEMPPLO:
propiedades del enlace covalente:
*solidos amorfos, liquidos y gases
*sus p. fusión y de ebullición son bajos
* solubilidad
soluto solvente
Cov. puro Cov. puro
Cov. no polar Cov. no polar
Cov. polar Cov. polar
* no conducen corriente electrica
IONIZACION
Ionización
La ionización es el proceso químico o físico mediante el cual se producen iones, estos son átomos o moléculas cargadas eléctricamente debido al exceso o falta de electrones respecto a un átomo o molécula neutro. A la especie química con más electrones que el átomo o molécula neutros se le llama anión, y posee una carga neta negativa, y a la que tiene menos electrones catión, teniendo una carga neta positiva. Hay varias maneras por las que se pueden formar iones de átomos o moléculas.En ciertas reacciones químicas la ionización ocurre por transferencia de electrones; por ejemplo, el cloro reacciona con el sodio para formar cloruro de sodio, que consiste en iones de sodio (Na+) e iones de cloruro (Cl-). La condición para que se formen iones en reacciones químicas suele ser una fuerte diferencia de electronegatividad entre los elementos que reaccionan o por efectos de resonancia que estabilizan la carga. Además la ionización es favorecida por medios polares que consiguen estabilizar los iones. Así el pentacloruro de fósforo (PCl5) tiene forma molecular no iónica en medios poco polares como el tolueno y disocia en iones en disolventes polares como el nitrobenceno (O2NC6H5).
La presencia de ácidos de Lewis como en los haluros de aluminio o el trifluoruro de boro (BF3) también puede favorecer la ionización debido a la formación de complejos estables como el [AlCl4-]. Así la adición de tricloruro de aluminio a una disolución del cloruro de tritl (Cl-CPh3), un compuesto orgánico, resulta en la formación del tetracloroaluminato de tritilio ([AlCl4]-[CPh3]+, una sustancia iónica y la adición de cloruro de alumino a tetraclorociclopropeno (C3Cl4, un líquido orgánico volátil) proporciona el tetracloroaluminato de triclorociclopropenilio ([AlCl4]-[C3Cl3]+ como sólido incoloro. A este proceso se le suman las umas de los electrones compuestos por menos cargas negativas al núcleo de el primer átomo consecutivo.
En los procesos físicos se suelen separar los electrones de una molécula neutra. Para lograrlo hay que aportar la energía necesaria. Esto es posible calentando hasta una elevada temperatura (se suele formar un plasma), mediante irradiación ionizante (por ejemplo, luz ultravioleta, rayos X o radiactividad alfa, beta o gamma), aplicando campos eléctricos fuertes, o bombardeando una muestra con partículas. Se genera de esta forma una partícula con carga positiva (catión) además de un electrón libre.
Los procesos de ionización están implicados en la formación del rayo durante las tormentas, en la generación de luz en las pantallas de plasma, en las lámparas fluorescentes y son la base de la espectroscopía de masas.
PROPIEDADES FISICAS DE LA MATERIA
Propiedades físicas de la materia
La manera en que se comporta cualquier clase de materia, depende de la forma que se unen entre sí los átomos de esa materia. Cada propiedad de la materia está relacionada con los átomos. Algunos ejemplos:Presión – Cuando hinchamos un globo, bombardeamos montones de moléculas de aire en su interior. Esas moléculas van de un lado para otro dentro del globo y, cuando golpean su pared, rebotan. Cada rebote ejerce una diminuta fuerza en el globo, y la presión que podemos leer en un indicador de presión es sólo la suma total de todas esas fuerzas.

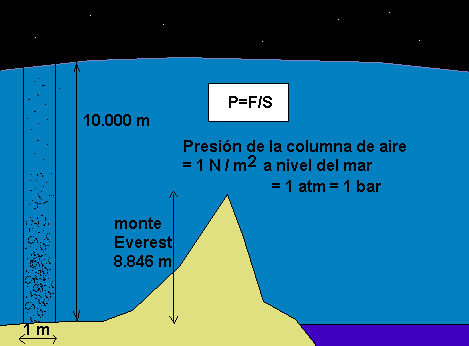
Presión del aire y el agua – Tanto el aire como el agua están hechos de moléculas, y ambos son en consecuencia capaces de ejercer una presión. Las moléculas en un cubo de agua en medio del océano, por ejemplo, ejercerán una presión contra todos los lados del cubo: arriba, abajo y hacia los lados.

Si imaginamos una columna de agua que se extiende hacia abajo en el océano, la fuerza de la gravedad hacia abajo sobre esa columna tiene que ser equilibrada por la fuerza hacia arriba ejercida por el agua debajo de ella. Así, cuanto más bajemos en el océano (o en la atmósfera), mayor será la presión. Al nivel del mar, por ejemplo, el aire ejerce una presión de 1 kilo por cm2.
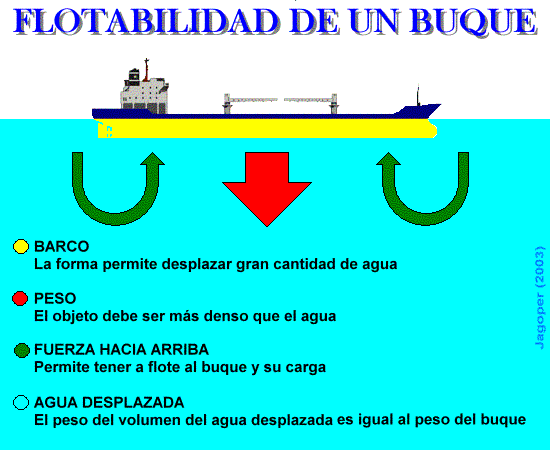
Flotabilidad – Si metemos algo en el agua, se ejercerá una presión sobre ello. El resultado de esta presión es una fuerza hacia arriba a la que llamamos flotabilidad. Esta fuerza es igual al peso del agua desplazada por el objeto, de modo que si el objeto es menos denso que el agua, flotará. De otro modo, se hundirá.
Podemos pensar por ejemplo, que cómo un transatlántico puede flotar si el hierro es más pesado que el agua. Pues debemos pensar que la cantidad de agua desplazada por el barco, es igual al volumen de hierro más el aire dentro del casco. Si el barco estuviera lleno de agua (o de hierro), se hundiría.
Adhesión y cohesión – Cuando las moléculas de algún material son atraídas a otras moléculas del mismo material, denominamos a esa fuerza cohesión. Es la fuerza que conserva las cosas de una pieza. Si las moléculas de diversas materias son atraídas unas a otras, la fuerza entonces se denomina cohesión. Dicha fuerza, permite que una cosa se pegue a otra. En los dos casos, sin embargo, la base para la fuerza es la atracción entre átomos.

Adhesión y cohesión
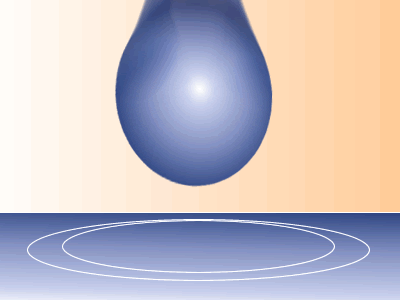
Tensión superficial – Las fuerzas cohesivas dentro de un líquido tienden a hacer que el líquido adopte forma esférica. Cuando una gota de agua “forma una cuenta” sobre un impermeable, es la fuerza de cohesión la que la mantiene así. Los físicos piensan en los efectos de la cohesión como en una fuerza que mantiene la superficie unida, y llaman a esa fuerza tensión superficial.

Elasticidad – Es la propiedad de los sólidos que les hace volver a su forma original cuando han sido deformados. Cuando doblamos una pieza de metal, sus átomos ejercen una fuerza que se opone al doblado. Tan pronto como la soltamos, las fuerzas interiores actúan y el metal vuelve a su posición original.


Compresibilidad – Puesto que las fuerzas entre los átomos pueden volverse repulsivas si los átomos son apretados demasiado juntos, los materiales se resisten a las fuerzas exteriores que intentan comprimirlos. Algunos materiales, como el acero y el agua, se resisten muy fuertemente. Otros, como el aire, no.
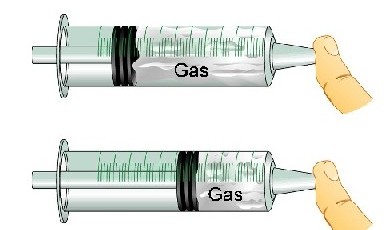
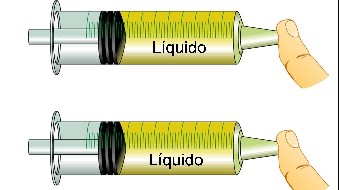
Fuerza tensora – Del mismo modo que los materiales se resisten a que sus átomos sean comprimidos juntos, se resisten también a que sean separados. La fuerza tensora mide la fuerza requerida para superar las fuerzas de atracción entre átomos y separarlos. El acero tiene también una alta fuerza tensora: resulta difícil separar sus átomos, aunque sea fácil romperlo.

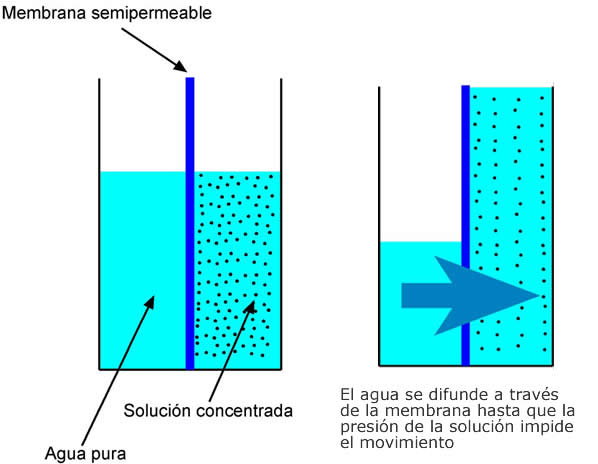
Ósmosis – Si dos soluciones son separadas por una membrana, el agua (pero no las moléculas en solución) puede moverse a través de la membrana, cambiando la concentración de la solución de ambos lados. Esto recibe el nombre de ósmosis. Cuando la piel presenta un aspecto arrugado después de estar en la bañera demasiado tiempo, es porque el agua ha fluido dentro de nuestras células por ósmosis.

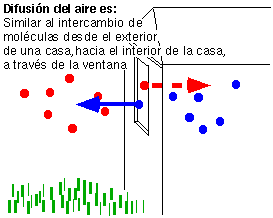
Difusión – Cuando las moléculas de dos fluidos distintos se unen al movimiento molecular normal, da como resultado que dos conjuntos de moléculas se entremezclen. Este proceso recibe el nombre de difusión. Si dejamos caer una gota de tinta en un vaso de agua, podemos seguir el rastro de la difusión a medida que la tinta se expande.
Puesto que la difusión depende sólo del movimiento de las moléculas, puede aparecer en lugares inesperados. Es bien sabido de los ingenieros, por ejemplo, que los gases pueden difundirse en (e incluso a través de) contenedores metálicos. Los científicos espaciales tienen que preocuparse por los gases que se difunden a través de las pareces de la nave espacial en las misiones largas.
Capilaridad – Si metemos un tubo delgado hueco en un líquido, el líquido ascenderá dentro del tubo con respecto al nivel exterior. Este efecto recibe el nombre de capilaridad. Funciona de esta forma: el empuje hacia abajo de la gravedad sobre el líquido en el tubo es superado por la fuerza de adhesión entre el líquido y las pareces del tubo.
Es la capilaridad la que alza el agua en las plantas (otro mecanismo que hace que entre el agua por las raíces es la ósmosis, pero lo que verdaderamente hace que suba el agua hacia las copas de los arboles (hasta 20-30 metros de altura), es la pérdida constante de agua que estos sufren por las hojas debido a la transpiración, creándose una presión negativa que se compensa con la entrada de agua nueva por las raíces).
Para un tubo de un tamaño determinado, hay un límite a lo alto que puede ascender un líquido. El peso de la columna líquida no puede exceder a la fuerza de ascensión ejercida por la cohesión.
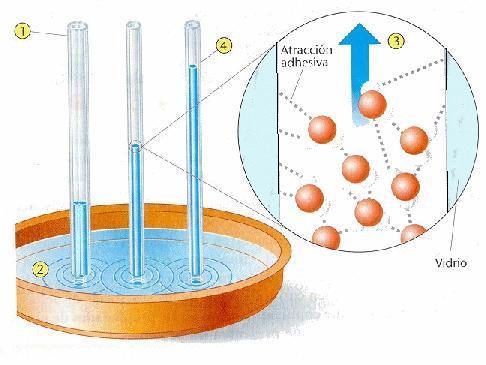
PROPIEDADES QUIMICAS
Una propiedad química es cualquier propiace evidente durante una reacción química; es decir, cualquier cualidad que puede ser establecida solamente al cambiar la identidad química de una sustancia. En otras palabras, las propiedades químicas no pueden ser determinadas simplemente por ver o tocar la sustancia, la estructura interna debe ser afectada para que sus propiedades químicas sean investizsgadas.
Las propiedades químicas pueden ser contrarrestadas con las propiedades físicas, las cuales pueden discernirse sin cambiar la estructura de la sustancia.
Afinidad electrónica
Alcalinidad
Alotropía
Anfoterismo
Aquiralidad
Calor de combustión
Composición centesimal
Concentración
Conductividad molar
Descenso crioscópico
Electrófilo
Electronegatividad
Energía de activación
Entalpía de formación
Entropía de formación
Estado de oxidación
Estereoquímica
Fosforescencia
Fundente
Hidrófilo
Hidrófobo
Higroscópico
Hipertónico
Hipotónico
Isotónico
Lipófilo
Masa atómica
Masa molar
Masa molecular
Metaestabilidad
Molecularidad
Momento dipolar químico
Número atómico
Osmolaridad
Peso molecular medio por partícula
Polaridad (química)
Potencial químico
Punto crítico
Punto de inflamabilidad
Punto de inflamación
Punto isoeléctrico
Quimioluminiscencia
Quiralidad (química)
Solubilidad
Sustancia vesicante
Tipo de enlace químico
Volumen molar
Estos son las caracteristicas de las propiedades quimicas
Las propiedades químicas pueden ser contrarrestadas con las propiedades físicas, las cuales pueden discernirse sin cambiar la estructura de la sustancia.
Ejemplos
AcidezAfinidad electrónica
Alcalinidad
Alotropía
Anfoterismo
Aquiralidad
Calor de combustión
Composición centesimal
Concentración
Conductividad molar
Descenso crioscópico
Electrófilo
Electronegatividad
Energía de activación
Entalpía de formación
Entropía de formación
Estado de oxidación
Estereoquímica
Fosforescencia
Fundente
Hidrófilo
Hidrófobo
Higroscópico
Hipertónico
Hipotónico
Isotónico
Lipófilo
Masa atómica
Masa molar
Masa molecular
Metaestabilidad
Molecularidad
Momento dipolar químico
Número atómico
Osmolaridad
Peso molecular medio por partícula
Polaridad (química)
Potencial químico
Punto crítico
Punto de inflamabilidad
Punto de inflamación
Punto isoeléctrico
Quimioluminiscencia
Quiralidad (química)
Solubilidad
Sustancia vesicante
Tipo de enlace químico
Volumen molar
Estos son las caracteristicas de las propiedades quimicas
PROPIEDADES DE LA MATERIA
PROPIEDADES DE LA MATERIA
| Todos los cuerpos tienen masa ya que están compuestos por materia. También tienen peso, ya que son atraídos por la fuerza de gravedad. Por lo tanto, la masa y el peso son dos propiedades diferentes y no deben confundirse. Otra propiedad de la materia es el volumen, porque todo cuerpo ocupa un lugar en el espacio. A partir de las propiedades anteriores surgen, entre otras, propiedades como la impenetrabilidad y la dilatabilidad. |
La materia está en constante cambio. Las transformaciones que pueden producirse son de dos tipos: - Físicas: son aquellas en las que se mantienen las propiedades originales de la sustancia ya que sus moléculas no se modifican. - Químicas: son aquellas en las que las sustancias se transforman en otras, debido a que los átomos que componen las moléculas se separan formando nuevas moléculas. |
La materia posee diversas propiedades mensurables y no mensurables. Éstas se pueden dividir en dos grupos:
- Propiedades generales: no permiten la identificación de la clase de materia (sustancia). Por ejemplo: la inercia y la extensión (mensurables); la impenetrabilidad (no mensurable).
- Propiedades características o específicas: permiten identificar la sustancia. Por ejemplo: el peso específico (relación entre el peso y el volumen —medidas de la inercia y la extensión de un cuerpo o porción de materia—); el sabor (no mensurable).
| PROPIEDADES GENERALES |
| Gravitación |
| Inercia |
| Divisibilidad |
| Extensión |
| Impenetrabilidad |
Suscribirse a:
Entradas (Atom)


![\mbox{pH} = -\log_{10} \left[ \mbox{a}_{H_3O^+} \right]](http://upload.wikimedia.org/wikipedia/es/math/7/b/7/7b7e772992e9d43888cd421cba60c766.png)
![\operatorname{pH} = -\log[H^+] \,\!](http://upload.wikimedia.org/wikipedia/es/math/d/b/2/db2b6c245a653db6b4809c594220342e.png)

