HIPOTESIS: Obtener el agua con calor aplicando al oxigeno y el doble del hidrogeno
OBJETIVO: Sintetizar el agua
MATERIALES:
*Botella de vidrio
*Oxigeno
*Cerrillos
*Soporte Universal completo
*Pinzas te tubo de ensayo
*Tubo de desprendimiento
*Bandeja
*Mangera
*Mechero
*Tapones
sábado, 8 de octubre de 2011
OBTENCION DEL HIDROGENO
OBJETIVO: Obtencion del hidrogeno
HIPOTESIS: Separar acido cloridico pra obtener hidrogeno
MATERIAL:
* Botella y Charola
*Mangera y tapon
*Tuvo de ensayo
*Acido cloridico
*Gramilla di Zinc
PROCEDIMIENTO:
1.-Colocar en le tubo de ensayo el acido cloridico
2.-Preparar con el tapon de mangera y pasarlo a la botella
3.-Colocar la gramilla de Zing dentro del tubo y tapar rapidamente
4.-Suspender cuando las otras partes esten llenas
5.-Poner la botella en posicion vertical
6.-Sacar y tapar rapidamente
HIPOTESIS: Separar acido cloridico pra obtener hidrogeno
MATERIAL:
* Botella y Charola
*Mangera y tapon
*Tuvo de ensayo
*Acido cloridico
*Gramilla di Zinc
PROCEDIMIENTO:
1.-Colocar en le tubo de ensayo el acido cloridico
2.-Preparar con el tapon de mangera y pasarlo a la botella
3.-Colocar la gramilla de Zing dentro del tubo y tapar rapidamente
4.-Suspender cuando las otras partes esten llenas
5.-Poner la botella en posicion vertical
6.-Sacar y tapar rapidamente
MODELOS ATOMICOS
Modelo atómico de Dalton
El modelo atómico de Dalton, surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, formulado en 1808 por John Dalton. El siguiente modelo fue el modelo atómico de Thomson.
Postulados de Dalton
Dalton explicó su teoría formulando una serie de enunciados simples:[1]
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Éxitos del modelo
- El modelo atómico de Dalton explicaba por qué las sustancias se combinaban químicamente entre sí sólo en ciertas proporciones.
- Además el modelo aclaraba que aún existiendo una gran variedad de sustancias, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos.
- En esencia, el modelo explicaba la mayor parte de la química orgánica del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria.
Modelo atómico de Dalton
Introduce la idea de la discontinuidad de la materia, es decir, esta es la primera teoría científica que considera que la materia está dividida en átomos (dejando aparte a precursores de la Antigüedad como Demócrito y Leucipo, cuyas afirmaciones no se apoyaban en ningún experimento riguroso).
Los postulados básicos de esta teoría atómica son:
Actualmente, se sabe que los atomos sí pueden dividirse y alterarse.
Actualmente, es necesario introducir el concepto de isótopos: átomos de un mismo elemento, que tienen distinta masa, y esa es justamente la característica que los diferencia entre sí.
Al suponer que la relacion numerica entre los atomos era la más sencilla posible, Dalton asignó al agua la formula HO, al amoníaco la formula NH, etc.
Modelo atómico de Thomson
Introduce la idea de que el átomo puede dividirse en las llamadas partículas fundamentales:
- Electrones, con carga eléctrica negativa
- Protones, con carga eléctrica positiva
- Neutrones, sin carga eléctrica y con una masa mucho mayor que la de electrones y protones.
Modelo atómico de Rutherford.

En 1911, Rutherford introduce el modelo planetario, que es el más utilizado aún hoy en día. Considera que el átomo se divide en:
- un núcleo central, que contiene los protones y neutrones (y por tanto allí se concentra toda la carga positiva y casi toda la masa del átomo)
- una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol.
Modelo atómico de Thomson
El modelo atómico de Thomson, es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, descubridor del electrón[1] en 1897, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, como un pudin de pasas.[2] Se pensaba que los electrones se distribuían uniformemente alrededor del átomo. En otras ocasiones, en lugar de una sopa de carga negativa se postulaba con una nube de carga positiva.
Dicho modelo fue rebatido tras el experimento de Rutherford,[3] cuando se descubrió el núcleo del átomo. El modelo siguiente fue el modelo atómico de Rutherford.[4
Modelo atómico de Thomson

Modelo atómico de Thomson
Descubrimiento del electrón (descubierto en el año 1897; en 1898 Thomson propuso un modelo atómico, que tomaba en cuenta la existencia de dicha partícula subatómica.
Thomson suponía que los electrones se distribuía de una forma uniforme alrededor del átomo, conocido este modelo como Pastel de pasas, es la teoría de estructura atómica, Thomson descubre el electrón antes que se descubrirse el portón y el neutrón..
Si observamos este modelo, veremos que el átomo se compone por electrones de carga negativa en el átomo positivo, tal se aprecia en el modelo de pasas de budín.
Pensaba que los electrones, distribuidos uniformemente alrededor del átomo, en distintas ocasiones, en vez de una sopa de las cargas positivas, se postulaba con una nube de carga positiva, en 1906 Thomson fue premiado con el novel de física por este descubrimiento.
Si pensamos que el átomo no deja de ser un sistema material, con una cierta energía interna, es por eso que esta energía provoca un grado de vibración de los electrones contenidos que contiene su estructura atómica, si se enfoca desde este punto de vista el modelo atómico de Thomson se puede afirmar que es muy dinámico por consecuencia de la gran movilidad de los electrones en el “seno” de la mencionada estructura.
Para lograr una interpretación del modelo atómico desde un ángulo microscópico, entonces se puede definir como una estructura estática, ya que los mismos se encuentran atrapados dentro del “seno” de la masa que define la carga positiva del átomo.
Veamos el modelo de una forma simple, el modelo de Thomson era parecido a un pastel de Frutas: los electrones estaban incrustados en una masa esférica de carga positiva,
La carga negativa del electrón era la misma que la carga positiva de la esfera, es por esto que se deduce que el átomo era neutro.
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para explicar los resultados de su "experimento de la lámina de oro", realizado en 1911.
El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo", muy pequeño, que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Thomson suponía que los electrones se distribuía de una forma uniforme alrededor del átomo, conocido este modelo como Pastel de pasas, es la teoría de estructura atómica, Thomson descubre el electrón antes que se descubrirse el portón y el neutrón..
Si observamos este modelo, veremos que el átomo se compone por electrones de carga negativa en el átomo positivo, tal se aprecia en el modelo de pasas de budín.
Pensaba que los electrones, distribuidos uniformemente alrededor del átomo, en distintas ocasiones, en vez de una sopa de las cargas positivas, se postulaba con una nube de carga positiva, en 1906 Thomson fue premiado con el novel de física por este descubrimiento.
Si pensamos que el átomo no deja de ser un sistema material, con una cierta energía interna, es por eso que esta energía provoca un grado de vibración de los electrones contenidos que contiene su estructura atómica, si se enfoca desde este punto de vista el modelo atómico de Thomson se puede afirmar que es muy dinámico por consecuencia de la gran movilidad de los electrones en el “seno” de la mencionada estructura.
Para lograr una interpretación del modelo atómico desde un ángulo microscópico, entonces se puede definir como una estructura estática, ya que los mismos se encuentran atrapados dentro del “seno” de la masa que define la carga positiva del átomo.
Veamos el modelo de una forma simple, el modelo de Thomson era parecido a un pastel de Frutas: los electrones estaban incrustados en una masa esférica de carga positiva,
La carga negativa del electrón era la misma que la carga positiva de la esfera, es por esto que se deduce que el átomo era neutro.
Modelo atómico de Rutherford
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para explicar los resultados de su "experimento de la lámina de oro", realizado en 1911.
El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo", muy pequeño, que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Introducción
Antes de la propuesta de Rutherford, los físicos aceptaban que las cargas eléctricas en el átomo tenían una distribución más o menos uniforme. Rutherford trató de ver cómo era la dispersión de las partículas alfa por parte de los átomos de una lámina de oro muy delgada. Los ángulos resultantes de la desviación de las partículas supuestamente aportarían información sobre cómo era la distribución de carga en los átomos. Era de esperar que, si las cargas estaban distribuidas uniformemente según el modelo atómico de Thomson, la mayoría de las partículas atravesarían la delgada lámina sufriendo sólo ligerísimas deflexiones, siguiendo una trayectoria aproximadamente recta. Aunque esto era cierto para la mayoría de las partículas alfa, un número importante de estas sufrían deflexiones de cerca de 180º, es decir, prácticamente salían rebotadas en dirección opuesta a la incidente.
Rutherford pensó que esta fracción de partículas rebotadas en dirección opuesta podía ser explicada si se suponía la existencia de fuertes concentraciones de carga positiva en el átomo. La mecánica newtoniana en conjunción con la ley de Coulomb predice que el ángulo de deflexión de una partícula alfa relativamente liviana por parte de un átomo de oro más pesado, depende del "parámetro de impacto" o distancia entre la trayectoria de la partícula y el núcleo:
| ||||||||
Características del Modelo En 1911, Rutherford introduce el modelo planetario, que es el más utilizado aún hoy en día. Considera que el átomo se divide en: · Un núcleo central, que contiene los protones y neutrones (y por tanto allí se concentra toda la carga positiva y casi toda la masa del átomo). · Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol. Los experimentos de Rutherford demostraron que el núcleo es muy pequeño comparado con el tamaño de todo el átomo: el átomo está practicamente hueco. Modelo atómico de BohrEl modelo atómico de Bohr o de Bohr-Rutherford es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados (ver abajo). Fue propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905. IntroducciónBohr se basó en el átomo de hidrógeno para hacer el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o la órbita más cercana posible al núcleo. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de Número Cuántico Principal. Bohr supuso además que el momento angular de cada electrón estaba cuantizado y sólo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno. Estos niveles en un principio estaban clasificados por letras que empezaban en la "K" y terminaban en la "Q". Posteriormente los niveles electrónicos se ordenaron por números. Cada órbita tiene electrones con distintos niveles de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado, dependiendo de la energía que posea, para liberarse sin problema y de nuevo volver a su órbita de origen. Sin embargo no explicaba el espectro de estructura fina que podría ser explicado algunos años más tarde gracias al modelo atómico de Sommerfeld. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica. [editar] Postulados de BohrEn 1913, Niels Bohr desarrolló su célebre modelo atómico de acuerdo a tres postulados fundamentales:[1][editar] Primer postuladoLos electrones describen órbitas circulares en torno al núcleo del átomo sin radiar energía.La causa de que el electrón no radie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica un carga en movimiento acelerado debe emitir energía en forma de radiación. Para conseguir el equilibrio en la órbita circular, las dos fuerzas que siente el electrón: la fuerza coulombiana, atractiva, por la presencia del núcleo y la fuerza centrífuga, repulsiva por tratarse de un sistema no inercial, deben ser iguales en módulo en toda la órbita. Esto nos da la siguiente expresión:
Y ahora con ésta ecuación y sabiendo que la energía total es la suma de las energías cinética y potencial:
[editar] Segundo postuladoNo todas las órbitas para electrón están permitidas, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular, L, del electrón sea un múltiplo entero de . Esta condición matemáticamente se escribe: . Esta condición matemáticamente se escribe:
Igual que antes, para el átomo de Hidrógeno (Z=1) y el primer nivel permitido (n=1), obtenemos:
[editar] Tercer postuladoEl electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles. Este fotón, según la ley de Planck tiene una energía:
A veces, en vez de la frecuencia se suele dar la inversa de la longitud de onda: Ésta última expresión fue muy bien recibida porque explicaba teóricamente la formula fenomenológica hallada antes por Balmer para describir las líneas observadas desde finales del siglo XIX en la desexcitación del Hidrógeno, que venían dadas por:
Se puede demostrar que este conjunto de hipótesis corresponde a la hipótesis de que los electrones estables orbitando un átomo están descritos por funciones de onda estacionarias. Un modelo atómico es una representación que describe las partes que tiene un átomo y como están dispuestas para formar un todo. Basándose en la constante de Planck 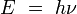
|
| |||||||
Suscribirse a:
Entradas (Atom)





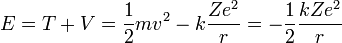





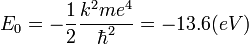





 , y donde
, y donde 